Besoin d'information ?
Contactez-nous
You are here
CMV R-GENE®
Trousse de PCR* en temps réel pour la détection et la quantification de l’ADN du cytomégalovirus (CMV)
- Quantification précise de la charge virale du CMV sur une gamme de linéarité étendue
- Réactifs prêts à l’emploi comprenant le contrôle interne et les standards de quantification
- Marquée CE-IVD sur l’ensemble des principales plateformes d’extraction et des systèmes de PCR en temps réel et sur différents types d’échantillons
Besoin d'information complémentaire ?
Application Clinique
Février 2019
Avantages de CMV R-GENE®
L'infection à CMV est une complication grave chez les patients immunodéprimés. C’est pourquoi la détection et le suivi optimisé des infections à CMV est un enjeu crucial pour la prise en charge des patients. Le test de PCR en temps réel CMV R-GENE® permet une détection rapide et spécifique du CMV avant l’apparition de symptômes cliniques. La mesure de la charge virale et de sa cinétique permettent pendant le traitement d’estimer son efficacité et par la suite de suivre les potentielles rechutes.
En outre, pour plus d’efficacité, l’utilisation de la gamme exhaustive R-GENE® vous permet de procéder à la détection et/ou à la quantification de plusieurs virus à partir d’un seul échantillon ou d’analyser simultanément plusieurs échantillons pour détecter un même virus.
- Sensible et reproductible
- Mesure fiable de l’infection à CMV
- Sensibilité analytique : 95% de probabilité de détecter le virus CMV dans du sang total contenant 446 copies/mL
- Gamme de quantification dynamique : de 500 à 107 copies/mL
- Mesure fiable de l’infection à CMV
- Standardisé
- Traitement simultané de plusieurs analyses grâce à la gamme de produits R-GENE® (EBV R-GENE®, HSV1 HSV2 VZV R-GENE®, HHV6 R-GENE®, BK Virus R-GENE®, Adenovirus R-GENE®, Parvovirus B19 R-GENE®)
- Profils de tests harmonisés pour procéder simultanément à plusieurs essais
- Protocole de conversion des résultats quantitatifs sur sang total en UI/mL tel que défini dans le premier standard international de l’OMS**
- Flexible
- Trousse validée pour une utilisation avec différents types d’échantillons
- Trousse validée pour les principales plateformes de PCR en temps réel
- Trousse validée pour une utilisation avec différents types d’échantillons
Tout ce dont vous avez besoin dans une seule trousse
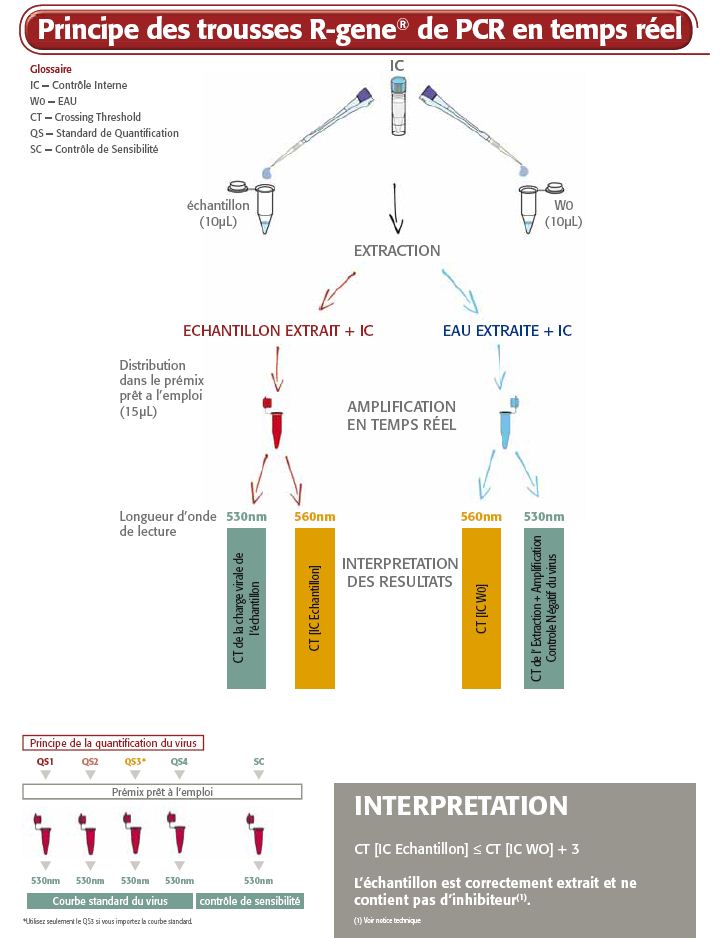
La trousse CMV R-GENE® est un kit de détection moléculaire prêt à l’emploi. Elle permet de détecter une région spécifique du génome du CMV et de mesurer sa charge virale par amplification PCR en temps réel après extraction de l'ADN viral. Le principe de la trousse est basé sur la technologie Taqman 5’ nucléase .
- Quatre standards de quantification permettent de mesurer précisément la charge virale du CMV
- Un contrôle de sensibilité valide les performances du test
- Un contrôle interne (IC2) vérifie le processus d’extraction, dès l’étape de lyse, et la présence d’inhibiteurs d’amplification dans l’échantillon
- Sont inclus tous les réactifs optimisés nécessaires pour détecter et quantifier le virus CMV à des fins de diagnostic in vitro
Une procédure facile
La trousse CMV R-GENE® est simple à utiliser. Il vous suffit d’ajouter l’ADN extrait de l’échantillon au prémix d'amplification PCR prêt à l’emploi et de commencer la réaction sur le thermocycleur de PCR en temps réel approprié, en suivant le programme de cycles optimisé décrit dans les « Instructions d’utilisation » de la Notice Technique.
**OMS : Organisation Mondiale de la Santé
Les autres marques et noms de produits mentionnés appartiennent à leurs propriétaires respectifs.
Application Clinique
Février 2019
| CMV R-GENE® (69-003B) | |
|---|---|
| Principe du test | Détection et quantification du génome du CMV |
| Références de commande | Référence 69-003B : Trousse de quantification CMV R-GENE® |
| Technologie | PCR en temps réel / Technologie Taqman 5’ nucléase |
| Gène cible | Gène codant pour la protéine ppUL83 |
| Échantillon | Sang total, plasma, sérum, liquide céphalorachidien, liquide amniotique, biopsies, urine, LBA |
| Limite de détection | LoD* 95 % : 446 copies/mL |
| Gamme de quantification dynamique | De 500 à 107 copies/mL |
| Contrôles inclus | Contrôle d’extraction + inhibition, contrôle de sensibilité, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Copies/mL ou conversion en UI/mL tel que défini dans le premier standard international de l’OMS |
| Nombre de tests | 90 tests |
| Conditions de conservation | -15°C/-31°C |
| Extraction validée manuelle ou automatisée |
EMAG®, QIAamp DNA Blood Mini kit, NUCLISENS® EASYMAG®, MagNA Pure Compact, MagNA Pure LC, MagNA Pure 96, QIAcube QIAsymphony SP
|
| Plateforme d’amplification validée |
- LightCycler 480 (System II).
- Applied Biosystems 7500, 7500 Fast, 7500 Fast Dx, 7300, ViiA™ 7 Real-Time PCR System (avec bloc pour plaques 96 puits et bloc pour plaques 96 puits Fast ), StepOne
- Rotor-Gene (barrettes PCR de 4 tubes)
- CFX 96 Real-Time System
|
| Statut | A utiliser pour le diagnostic in vitro |
*LoD = Limit of detection (en français Limite de détection)
Se reporter à la notice technique pour plus d’informations sur les performances et les plateformes d’extraction et d’amplification validées.
Produits appartenant à la liste B - LNE/G-MED et destinés aux professionnels de santé.
Application Clinique
Février 2019
Quelques informations sur le CMV
Qu’est-ce que le CMV ?
Le cytomégalovirus humain (CMVH) est un virus à ADN enveloppé double brin appartenant à la famille des Herpesviridae. Après la primo-infection, qui survient souvent dans la petite enfance, le CMVH persiste à l'état latent chez l'hôte et peut être responsable d'infections secondaires récurrentes, à la faveur d'une immunosuppression chronique ou transitoire, par réactivation du génome endogène ou par réinfection par une nouvelle souche. Les conséquences de l'infection à CMVH dépendent essentiellement de l'immunité cellulaire du sujet atteint. Le plus souvent asymptomatique chez les sujets sains, l'infection à CMVH peut conduire à des atteintes sévères chez les patients immunodéprimés et chez le fœtus ou le nouveau-né après transmission in utero.
Quelles sont les populations à risque ?
L'infection à CMVH après allogreffe d'organe ou de moelle : le CMVH est l'agent infectieux majeur après allogreffe de moelle osseuse et transplantation d'organe. L'infection à CMVH est observée, en moyenne, chez deux tiers des receveurs quel que soit le type de transplantation. Elle survient en l'absence de traitement prophylactique entre le 1er et le 4ème mois après la greffe. Elle est symptomatique deux fois sur trois en cas de primo-infection, dans 40% des cas de réinfection et moins de 20% des réactivations. Une fièvre prolongée peut être la seule manifestation clinique de l'infection ou se compliquer d'une thrombo-leucopénie, d'une hépatite cytolytique, d'atteintes digestives, d'une cystite. La pneumopathie interstitielle est une complication majeure de la greffe de moelle. Elle survient chez 20% environ des receveurs et son évolution, en l'absence de traitement est redoutable (90% de mortalité).
Pendant la grossesse, l’émergence d’une primo-infection maternelle occasionne des complications dans 50% des cas d’infections fœtales. Celles-ci sont graves dans environ 10% des cas, provoquant notamment des atteintes neurologiques.
Quels sont les avantages du test CMV ?
Les tests basés sur la PCR en temps réel pour le CMV permettent une détection rapide et spécifique avant l’apparition de symptômes cliniques, afin d’améliorer le pronostic, ce qui est particulièrement important chez les patients receveurs d’allogreffes d’organes ou de moelle osseuse et les patients atteints du VIH/sida. Le test permet de suivre l’efficacité d’un traitement actif et de surveiller les rechutes après traitement.
CMV R-GENE® et le premier standard international de l’OMS pour le cytomégalovirus humain
Vous avez besoin de calculer votre facteur de conversion pour exprimer vos résultats CMV R-GENE® en UI/ml ? Téléchargez un protocole de calcul.
| Téléchargez le protocole » | Téléchargez le fichier Excel » | Téléchargez le poster » |
Si vous souhaitez commander ce standard international CMV de l’OMS (code 09-162), contactez NIBSC en cliquant sur le lien suivant :
Remarque : les facteurs de conversion indiqués sur le poster servent uniquement à illustrer les combinaisons mentionnées. bioMérieux recommande vivement de déterminer le facteur de conversion au sein de votre laboratoire.
CMV R-GENE®: PUBLICATIONS
- Cytomegalovirus load in inflamed intestinal tissue is predictive of resistance to immunosuppressive therapy in ulcerative colitis.
Roblin X, Pillet S, Oussalah A, Berthelot P, Del Tedesco E, Phelip JM, Chambonnière ML, Garraud O, Peyrin-Biroulet L, Pozzetto B. Am J Gastroenterol. 2011 Nov;106(11):2001-8. Epub 2011 Jul 26. - Cytomegalovirus infection in severe burn patients monitoring by real-time polymerase chain reaction: A prospective study
Bordes et al. Burns. 2011 May;37(3):434-9. Epub 2011 Jan 14. - Interêt de la recherche du cytomegalovirus par polymerase chain reaction dans le syndrome de Posner-Schlossman
Rodier-Bonifas et al. Journal français d'ophtalmologie, 2011 ; 34, 24-29 - Evaluation of new commercial real-time PCR quantification assay for prenatal diagnosis of cytomegalovirus congenital infection.
Ducroux A, Cherid S, Benachi A, Ville Y, Leruez-Ville M.J Clin Microbiol. 2008 Jun;46(6):2078-80. Epub 2008 Apr 16. - Multicentric evaluation of a new commercial cytomegalovirus (CMV) real-time PCR quantification assay
Gouarin S, Vabret A, Scieux C, Agbalika F, Cherot J, Mengelle C, Deback C, Petitjean J, Dina J, Freymuth F. J Virol Methods. 2007 Dec;146(1-2):147-54. Epub 2007 Jul 27. - Detection of cytomegalovirus (CMV) DNA in EDTA whole-blood samples: evaluation of the quantitative artus CMV LightCycler PCR kit in conjunction with automated sample preparation.
Michelin BD, Hadzisejdic I, Bozic M, Grahovac M, Hess M, Grahovac B, Marth E, Kessler HH. J Clin Microbiol. 2008 Apr;46(4):1241-5. Epub 2008 Feb 13.
Produits appartenant à la liste B - LNE/G-MED et destinés aux professionnels de santé.
Lire les instructions figurant sur l’étiquetage et/ou la notice d’utilisation du/des produit(s)
Solutions bioMérieux COVID-19
Découvrir les tests de diagnostic du coronavirus SARS-COV-2
Découvrez également
- Diagnostic Clinique
- Microbiologie Industrielle
- Services
- Actus & Évènements
- Documents
- À propos
- Ma sélection
bioMérieux France - 5, rue des Aqueducs - B.P 10 - 69290 Craponne - France
- Mentions légales
- Vie privée
- Cookies
- Plan du site
- Contact
- Copyright 2022 bioMérieux SA